Die dynamische Welt der Mikroorganismen. Warum sollten sich unsere Mitbewohner nicht ändern dürfen? Und was wir daraus lernen müssen!
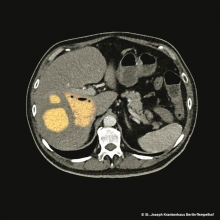
Wieso hat dieser Mann Leberabszesse?
Das Bild zeigt eine Computertomographie von Leberabszessen bei einem 53-jährigen in China geborenen Mann mit Diabetes mellitus. Der Patient stellte sich schwerkrank mit Zeichen der Sepsis in unserer Klinik vor. Auf dem Schnitt sieht man große Eiteransammlungen (orange) und Gas (schwarz) im Lebergewebe. Die Cholangien und die Gallenblase sind unauffällig, das Kolon weist keine Divertikel auf.
Leberabszesse, wie wir sie kennen, entstehen auf dem Boden von intraabdominellen Infektionen, hämatogen über die Pfortader oder aszendierend über die Gallenwege. Dieser Abszess hingegen ist bei einem (bis auf seine Zuckerkrankheit) gesunden Menschen aufgetreten, der im Vorfeld keine Infektion im Bauchraum hatte. Aus dem Punktat gelang der Nachweis eines aufstrebenden neuen Pathotyps der alt bekannten Klebsiella pneumoniae. Pathotyp? Das Wort fasst eine Gruppe von Organismen derselben Spezies zusammen, die ein charakteristisches Krankheitsbild verursachen (z.B. EHEC, EIEC, ETEC).
Klebsiellen des alten, klassischen Pathotyps verbinden wir mit Multiresistenz und nosokomialen Infektionen. Die neue Klebsielle ist anders: Sie fällt (noch) nicht durch ESBL-Bildung auf, sondern durch ihre extreme Aggressivität, was ihr den Spitznamen hypervirulente Klebsiella pneumoniae (hvKp) eingebracht hat. In einigen Regionen Asiens und den Pazifikanrainerstaaten ist sie zu einem relevanten Problem geworden. Patient*innen mit schlecht eingestelltem Diabetes mellitus erkranken häufiger schwer. Neben ambulant erworbenen Leberabszessen kann hvKp multiple oder metastatische Infektionen im ganzen Körper hervorrufen. Diese, für Enterobacteriaceae untypische Eigenschaft erinnert an die Virulenz von Staphylococcus aureus. Deshalb ist das diagnostische Workup bei beiden Spezies ähnlich umfangreich.
Die alten Klebsiellen zeichnen sich aus durch Resistenz, die neuen Klebsiellen durch Virulenz. Man muss kein Mikrobiologe sein, um auf die Idee zu kommen, dass Organismen der selben Spezies – genau, der bidirektionale Austausch von Resistenz- und Virulenzgenen zwischen den beiden Pathotypen ist in Gang.
Unser Patient hatte Glück, weil andere Organe, insbesondere Auge, Prostata und das ZNS ausgespart blieben. Der Abszess wurde erfolgreich drainiert. Die Antibiotikatherapie wurde fokussiert mit Ampicillin/Sulbactam, dem Betalaktam mit dem schmalsten Spektrum durchgeführt. Die Therapiedauer betrug vier Wochen.
Dr. med. Christoph Scheurich
Facharzt für Innere Medizin
Klinik für Infektiologie











