Manchmal kann man nur zusehen
1971 wurde aus dem Gehirn von John Cunningham, eines Patienten mit PML ein Poliomavirus isoliert. Es trägt seither - nach seinen Initialen - den Namen JCPyV (JC-Polyoma-Virus) oder kurz JC-Virus [1].
Bis in die 1980er Jahre galt die PML als Rarität. Betroffen waren wenige Patientinnen und Patienten mit lymphoproliferativen Erkrankungen der B-Zell Reihe. Das änderte sich im Zuge der HIV-Pandemie: Die PML war und ist seither eine der schrecklichsten Aids-definierenden Infektionen. Seitdem Immunsuppressiva wie Natalizumab, Rituximab und Dimetylfumarat zur Therapie von Autoimmunerkrankungen eingesetzt werden, erkranken auch vermehrt Patientinnen und Patienten ohne HIV-Infektion an einer PML.
Die klassische PML ist durch eine fortschreitende (Progressive) Destruktion von Oligodendrogliazellen und Astrozyten an verschiedenen (Multifokale) Orten der weißen Substanz (Leukenzephalopathie) des ZNS gekennzeichnet. Eine kausale Behandlung existiert nicht. Wenn es nicht gelingt, rasch das geschwächte Immunsystem zu stärken endet die Erkrankung mit dem Tode.
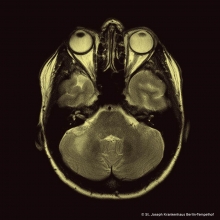
Unser Bild zeigt eine Kernspinntomographie einer 47 Jahre alten Frau ohne bekannte Vorerkrankungen, die sich im Dezember 2020 mit einer subakut aufgetretenen, schmerzlosen, dystonen Feinmotorikstörung der rechten Hand vorstellte. Wegen des radiologischen Befundes und des Nachweises von oligoklonalen Banden im Liquor wurde die Verdachtsdiagnose „Multiple Sklerose“ gestellt. Die Patientin wurde daraufhin mit Glucocorticoiden behandelt. Im kurzfristigen Verlauf entwickelte sie darunter ein Taubheitsgefühl des rechten Gesichts, Kribbelparästhesien des linken Arms und eine deutliche Verschlechterung des Ganges. Sie war nur noch wenige Schritte gehfähig bei fortbestehend schwerwiegender Koordinationsstörung der rechten Körperhälfte. Insgesamt verschlechterte sich ihr Zustand kontinuierlich und dramatisch.
Die Untersuchung einer Kleinhirnbiopsie war zunächst inkonklusiv. Erst mit der nachgereichten fokussierten Fragestellung konnte die Diagnose PML gestellt werden. Die Patientin hatte eine bis dahin undiagnostizierte HIV-Infektion. Im Bild sieht man eine PML-Manifestation im Marklager des rechten lobus posterior cerebelli.
Mehr als die Hälfte aller Erwachsenen ist mit JCPyV infiziert [2] und bleibt dies auch ein Leben lang, ganz ohne Symptome. Dieses Virus begleitet den Menschen länger als der Hund. Erstmals trafen JCPyV und Mensch im prähistorischen Afrika aufeinander und wir gehen seither gemeinsame Wege um den Globus. Das Virus ist wie ein Flugdatenschreiber anhand dessen man eine Weltkarte der Migrationsbewegungen der Menschheit erstellen kann [3]. Koevolution, sehr wahrscheinlich zum gegenseitigen Vorteil.
Wieso wird ein Virus, das uns seit Urzeiten wohlwollende Treue hält zu einem Pathogen? Um diese Frage zu beantworten müssen wir uns – fassungslos – einem virologischen Meisterstück stellen: Die Version von JCPyV, die millionenfach von gesundem Mensch zu gesundem Mensch übertragen wird trägt die Bezeichnung „Archetyp-Virus“ [4]. Es kann nicht viel mehr als in der Niere zu persistieren. Das ist schon OK, niemand findet daran Anstoß. Sobald aber bestimmte „Schenkel“ des Immunsystems des Wirts schwächeln, werden komplexe genetische Veränderungen (Rearrangements) in der non-coding control region (NCCR) des viralen Genoms in Gang gesetzt. Diese Transformationen sind die Vorraussetzung dafür, dass das Virus überhaupt in Gliazellen replizieren kann. Sie machen aus dem „Archetyp-Virus“ das „PML-Typ-Virus“ [5, 6]. Aber das reicht noch nicht! Es reicht noch nicht für eine Infektion der Zielzellen. Denn diesen Zellen fehlt ein Teil der Rezeptoren, die das Virus zum Zelleintritt benötigt [7]. Wie also gelangt das Virus in die Gliazellen? Die Antwort lautet: Es infiziert zunächst auf hämatogenem Wege die Endothelzellen des Ependyms und benutzt dann vom Ependym abgesonderte extrazelluläre Vesikel (kleine virushaltige Fetttröpfchen) um schließlich – rezeptorunabhängig, wie in einem trojanischen Pferd – Oligodendrogliazellen und Astrozyten zu entern [8-10]. Diese List erklärt die Erfolglosigkeit der Therapieansätze (z.B. Mirtazapin) die auf eine Blockade des rezeptorvermittelten Entrys von JCPyV abzielen.
Im nächsten Infektoskop berichten wir von kürzlich beschriebenen neuen Krankheitsmanifestationen und experimentellen Therapieansätzen mit Pembrolizumab und Nivolumab.
Wir haben bei unserer Patientin eine antiretrovirale Therapie begonnen und einen Behandlungsversuch mit Pembrolizumab unternommen in der Hoffnung, damit den Krankheitsprozess zum Stillstand zu bringen. Wir waren nicht erfolgreich. Manchmal kann man nur zusehen.
Dr. Hartmut Stocker
Facharzt für Innere Medizin, Infektiologie
Chefarzt der Klinik für Infektiologie und HIV-Medizin
Literatur:
- Padgett BL, Walker DL, ZuRhein GM, Eckroade RJ, Dessel BH: Cultivation of papova-like virus from human brain with progressive multifocal leucoencephalopathy. Lancet (London, England) 1971, 1(7712):1257-1260.
- Gossai A, Waterboer T, Nelson HH, Michel A, Willhauck-Fleckenstein M, Farzan SF, Hoen AG, Christensen BC, Kelsey KT, Marsit CJ et al: Seroepidemiology of Human Polyomaviruses in a US Population. Am J Epidemiol 2016, 183(1):61-69.
- Pavesi A: Detecting Traces of Prehistoric Human Migrations by Geographic Synthetic Maps of Polyomavirus JC. Journal of molecular evolution 2004, 58(3):304-313.
- Yogo Y, Kitamura T, Sugimoto C, Ueki T, Aso Y, Hara K, Taguchi F: Isolation of a possible archetypal JC virus DNA sequence from nonimmunocompromised individuals. Journal of Virology 1990, 64(6):3139-3143.
- Johnson EM, Wortman MJ, Dagdanova AV, Lundberg PS, Daniel DC: Polyomavirus JC in the context of immunosuppression: a series of adaptive, DNA replication-driven recombination events in the development of progressive multifocal leukoencephalopathy. Clinical & developmental immunology 2013, 2013:197807.
- Atkinson AL, Atwood WJ: Fifty Years of JC Polyomavirus: A Brief Overview and Remaining Questions. Viruses 2020, 12(9).
- Haley SA, O'Hara BA, Nelson CD, Brittingham FL, Henriksen KJ, Stopa EG, Atwood WJ: Human polyomavirus receptor distribution in brain parenchyma contrasts with receptor distribution in kidney and choroid plexus. The American journal of pathology 2015, 185(8):2246-2258.
- Handala L, Blanchard E, Raynal PI, Roingeard P, Morel V, Descamps V, Castelain S, Francois C, Duverlie G, Brochot E et al: BK Polyomavirus Hijacks Extracellular Vesicles for En Bloc Transmission. Journal of Virology 2020, 94(6).
- Morris-Love J, Gee GV, O’Hara BA, Assetta B, Atkinson AL, Dugan AS, Haley SA, Atwood WJ, Imperiale M, Galloway D: JC Polyomavirus Uses Extracellular Vesicles To Infect Target Cells. mBio 2019, 10(2).
- O’Hara BA, Morris-Love J, Gee GV, Haley SA, Atwood WJ: JC Virus infected choroid plexus epithelial cells produce extracellular vesicles that infect glial cells independently of the virus attachment receptor. PLoS Pathogens 2020, 16(3).











