Fieber nach Urlaub in Teneriffa: Vielen Dank für Ihre Hilfe
Anaplasmose, Bartonellose, Brucellose, Chikungunya-Fieber, CMV, Dengue, „Doxycycline-Deficient State“, EBV, Ehrlichiose, Histoplasmose, HIV, Influenza, Leptospirose, Pappataci-Fieber, Psittakose, Q-Fieber, Rickettsiose, Rückfallfieber, Sindbis-Fieber, Tularämie, Usutu-Virus, Vaskulitis, West-Nil-Fieber, Zika. Für diesen alphabetisch angeordneten Input aus Argentinien, Berlin, Brasilien, Chile, München und Heidelberg danken wir den Leserinnen und Lesern des letzten Infektoskops. Sie haben mit Ihren Gedanken unseren differentialdiagnostischen Ehrgeiz angestachelt und unseren Horizont erweitert. Ihre Beiträge haben wir weiter unten zusammengefasst.
Einige der von Ihnen vorgeschlagenen Differentialdiagnosen hatten wir in der Tat nicht in Erwägung gezogen und wir haben noch ein, zwei Untersuchungen auf Ihre Anregung nachgemeldet. Hinweise auf Ehrlichiose, Brucellose, Dengue sowie auf akute Infektionen mit CMV, EBV, HIV, Leptospiren, C. psittaci und C. burnetii konnten wir nicht finden. Die Rickettsien Serologie war schließlich nach Diskussionen hier im Team, nach Literaturrecherche und nach Berücksichtigung Ihrer Beiträge das Pferd auf das wir - genau wie viele von Ihnen - gewettet haben: Die IgM / IgG Titer gegen R. conorii und R. rickettsii waren am 28.08.2022 bei 1:<64 / 1:<64. Am 21.09.2022 bei 1:128 / 1:<64. Die Titer gegen R. typhi und R. prowazekii lagen am Ausgangstag bei 1:128 / 1:<64. Bei der Kontrolle haben wir IgM / IgG Titer von 1:>1024 / 1:2048 gemessen. Eine Infektion mit R. typhi, dem Erreger des murinen Fleckfiebers ist damit sehr wahrscheinlich. Der Patient ist drei Wochen nach Therapiebeginn genesen und das pulmonale Infiltrat war nach der Therapie mit Doxycyclin fast komplett verschwunden.
Was sprach vor dem Eintreffen der Serologie für und was sprach gegen diese Diagnose?
Epidemiologie: Gibt es murines Fleckfieber auf den Kanarischen Inseln, haben wir uns gefragt. Ja, natürlich. R. typhi gibt es überall auf der Welt und somit auch auf den Kanaren, wo die Häufigkeit in den letzten Jahren zu steigen scheint. Der Inzidenzgipfel liegt dort zwischen Juli und November. 73% der Betroffenen in einer Serie von 221 Fällen waren Männer und 66% hatten Kontakt zu Hunden [1]. Letzteres mag überraschen, da R. typhi klassisch durch Flöhe übertragen wird, die an Ratten, Beutelratten und Katzen saugen. In Spanien sind aber auch Hunde infiziert [2] und damit ein Reservoir. Die Erkrankung kann zudem durch Inhalation von aufgewirbelten Flohexkrementen erworben werden.
Klinik und Untersuchungsbefunde: Die mittlere Inkubationszeit des murinen Fleckfiebers beträgt 10 (6 - 18) Tage, was in diesem Fall nicht unbedingt zur Abgrenzung von anderen Erkrankungen beiträgt. In Bezug auf die klinischen Manifestationen und die Laborwertveränderungen fassen wir hier die Daten aus zwei Fallserien zusammen: Der oben schon zitierten Serie von den Kanaren [1] und einer zweiten Serie aus Griechenland, die 90 Patientinnen und Patienten mit dieser Erkrankung analysiert [3]. In Bezug auf die Abwesenheit eines Eschars verweisen wir auf Ihre Diskussionsbeiträge und einen wenig zitierten aber praktisch sehr hilfreichen Artikel [4]. Kurz zusammengefasst, tritt bei Infektionen mit R. rickettsii, R. typhi und R. prowazekii fast nie ein Eschar auf. R. rickettsii (Rocky Mountain Spotted Fever) kommt nur in Amerika vor und fällt somit als Differentialdiagnose weg. R. prowazekii ein Erreger, der im Krieg und Elend seine besten Chancen hat, wird vermutlich bei einem Urlaubsaufenthalt im sonnigen Resort mit leichter, frisch gewaschener Kleidung keinen Stich machen und fällt somit auch als Differentialdiagnose weg (was auch für B. quintana gilt). Viele andere Rickettsiosen gehen mit einem Eschar und Exanthem mit Befall von Handflächen und Fußsohlen (z.B. R. conorii) oder schmerzhafter Lymphadenopathie ohne Exanthem (z.B. R. slovaca) einher.
Kopfschmerzen und Myalgien – die unspezifischen Symptome unseres Patienten traten auf den Kanaren und in Griechenland bei murinem Fleckfieber bei 88% bzw. bei 54% bis 73% der Patientinnen und Patienten auf [1, 3], genau wie bei vielen anderen Differentialdiagnosen.
Laborwerte: Die in den beiden Fallserien berichteten Leukozytenzahlen sind – wie der Hb-Wert – nicht Weg weisend. Über die Hälfte der Patientinnen und Patienten hatte allerdings eine Thrombozytopenie, und die Transaminasen waren erhöht. Aus Griechenland wird ein medianer GPT Wert von 69 U/L mit einem Maximum von 285 U/L berichtet. Unser Patient hatte deutlich höhere Werte, was uns etwas verunsicherte. Die LDH war bei Patientinnen und Patienten in beiden Serien erhöht. In Spanien bei 95% der Fälle mit einem Spitzenwert in Griechenland von 1.386 U/L. Das sind leider alles Befunde, die eine Abgrenzung zu anderen Rickettsiosen und zu Infektionen mit C. psittaci [5] nicht erlauben.
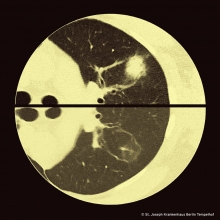
Bildgebung: Das pulmonale Infiltrat hat uns zunächst von der Idee des murinen Fleckfiebers abgebracht. In Spanien manifestiert sich die Erkrankung am häufigsten in der Niere im Sinne einer Proteinurie (87%), und der Leber im Sinne eines Anstiegs der Transaminasen (93%). Zu einer Pneumonie kommt es aber nur sehr selten (4%) obwohl Husten ein prominentes Symptom ist [1]. Die Fallserie aus Griechenland spricht immerhin von einer Lungenbeteiligung bei 17%. Wenn sie auftrat, dann allerdings in Form von interstitiellen Infiltraten [3]. Sucht man lange genug, findet man aber einen Artikel, der zwei Fälle mit „Round Pneumonia“ bei murinem Fleckfieber beschreibt. Und wo sind diese „Rundpneumonien“ aufgetreten? Auf den Kanaren [6].
Ihre und unsere Differentialdiagnosen: Lassen Sie uns – der Einfachheit halber – von einem „Doxycycline-Deficient State“ ausgehen, weil der Patient nach Beginn der Therapie mit Doxy so rasch und eindrücklich besser wurde. Nehmen wir also an, das war kein Zufall, sondern ein Therapieeffekt. Und lassen Sie uns die Rickettsiosen mit Eschar und mit Exanthem an Handflächen und Fußsohlen außer Acht lassen. Dann fallen alle viralen Erkrankungen die in die Diskussion einflossen weg. Es fallen auch die Pilzerkrankungen wie die Histoplasmose und die nicht infektiologischen Erkrankungen weg.
Die Ehrlichiose / Anaplasmose wurde von Ihnen ins Rennen geschickt: Die Seroprevalenz bei Hunden schließt diese Differentialdiagnose für unseren kanarischen Patienten nicht aus [7]. Für diese Erkrankungen würden laborchemisch die Thrombozytopenie, die Hepatitis und die hohe LDH sprechen [8]. Eine Pneumonie ist aber nicht beschrieben. Außerdem fehlt außerhalb der USA meist der Rash [9].
Die Psittakose war für uns – genau wie für viele von Ihnen – eine wichtige Differentialdiagnose. Wobei ein Exanthem eine Rarität zu sein scheint [5, 10] und wenn es auftritt, dann in Form der von Ihnen genannten „Horder Spots“ im Gesicht oder als Erythema multiforme / Erythema nodosum, was unser Patient definitiv nicht hatte.
Auch Q-Fieber gibt es auf den Kanaren [11]. In Bezug auf die Klinik, Laborwertveränderungen und Manifestationen haben uns vier Fallserien geholfen, die Wahrscheinlichkeit für diese Erkrankung bei unserem Patienten abzuschätzen: Eine Studie aus Marseille mit über 1.000 Patient*innen [12]. Eine Studie aus Südkorea mit 48 [13] sowie eine Studie aus den Niederlanden mit 183 Patientinnen und Patienten [14]. Fraglich ist allerdings, ob sich aus der Anamnese unseres Patienten ein reales Expositionsrisiko ableiten lässt. Die unspezifischen Symptome wie Fieber, Husten, Kopfschmerzen und Myalgien lassen eine Abgrenzung zum Fleckfieber nicht zu. Ein Rash wurde in diesen drei Serien nur bei 1% bis 11% der Fälle berichtet. Thrombozytopenie und Transaminasenerhöhung bei weniger als der Hälfte der Fälle. Die LDH ist in allen drei Serien nicht erwähnt. Die vierte Serie mit 30 Patientinnen und Patienten aus Valencia gibt die Rate an LDH Erhöhung mit 52% an. Summa summarum schien uns die DD „akutes Q-Fieber“ weniger plausibel, weil eine Exposition unwahrscheinlich war, nur selten ein Rash auftritt, und die Transaminasen bei dieser Erkrankung nicht regelhaft ansteigen.
So könnte man alle denkbaren Differentialdiagnosen durchdeklinieren und es bleibt dennoch stets eine spannende Unsicherheit bestehen, die sich durch eine akademische Aufarbeitung der Literatur nicht beseitigen lässt. Hier kommt wieder unser Freund der „Confirmation Bias“ ins Spiel:
Wenn ein nicht vorhandener Befund (z.B. ein Eschar), in der Literatur über unserer Top-Hypothese selten vorkommt, interpretieren wir das als Bestätigung dieser Hypothese. Wenn aber ein vorhandener Befund (z.B. die Pneumonie), in der Literatur über unsere Top-Hypothese selten vorkommt, interpretieren wir dies trotzdem als Bestätigung unserer Hypothese nach dem Motto: „Gut, ist eine Rarität, aber schließt es nicht aus“.
Nur wenige von uns haben das Privileg, unzählige Patientinnen und Patienten mit den genannten Erkrankungen persönlich behandelt und dabei ein Gespür für die Klinik, Laborwertveränderungen und die Bildgebung entwickelt zu haben.
Wegen dieses Mangels an eigener Erfahrung mit seltenen Infektionserkrankungen würden wir uns umso mehr darüber freuen, wenn wir in Zukunft regelmäßig solche Fälle gemeinsam diskutieren und voneinander lernen.
Dr. Hartmut Stocker
Facharzt für Innere Medizin, ZW Infektiologie
Klinik für Infektiologie und HIV-Medizin
Beiträge und Rückmeldungen zum Infektoskop vom 16.09.2022
Fieber nach Urlaub in Teneriffa: Wir brauchen Ihre Hilfe
Tobias Wagelöhner
Das ist ja ein spannender Fall, den ihr da bekommen habt. Hoffentlich geht es ihm weiter besser nach dem Doxycyclin.
Die Stiche, die er hatte schiebt er auf Ameisen? Könnten es auch Sandfliegen, Läuse oder Flöhe gewesen sein? Hat die Partnerin ähnliche Erscheinungen? Was ist mit den Kindern? Verlief das Fieber episodenhaft?
Zum Exanthem und den Kopf-, Glieder- und Gelenkschmerzen fallen mir virale Erkrankungen wie Dengue- und Chikungunya-Fieber ein, oder auch West-Nil-Fieber und Sindbis-Fieber. Die Influenza habt ihr bestimmt ausgeschlossen. Ebenso HIV und Lues und EBV/CMV. Eine nicht bekannte Immunsuppression wurde nicht entdeckt? Sind Lymphkontenschwellungen aufgetreten?
Die Frage ist auch, ob die Gelenkschmerzen und Gliederschmerzen einfach nur eine Reaktion auf das Fieber sind und gar nicht krankheitsspezifisch. Auch der Lungenherd kann etwas zufällig Entdecktes sein, da er bereits konsolidiert ist.
Kot und Stäube:
- Chlamydieninfektionen (Psittakose – dazu würde auch das Röntgen passen)
- Histoplasmose
Bisse/Stiche:
Dabei denke ich an murines oder epidemisches Fleckfieber als Rickettsiose (R. typhi, R. prowazekii). Da kann der Eschar fehlen und man hat nur das „fleckige“ Exanthem. Übertragung durch Läuse und Flöhe. Hat er Zecken an sich gesehen? Wobei die Hyalomma Zecke sich ja nicht so phlegmatisch ansaugt wie die deutsche Ixodes. In diese Richtung könnte man auch noch Bartonellose (B. quintana, B. henselae) oder Borreliose (hier aber Rückfallfieber? Bei episodischem Verlauf?) diskutieren. Q-Fieber ist auch immer gut. Und Doxycyclin würde helfen.
Woran ich bei der Recherche noch denke:
- Tularämie, Brucellose, Leptospirose
- Eine nicht infektiöse Erklärung wäre eine Vaskulitis (Hatte einen ähnlichen Fall in der Facharztprüfung, das war dann eine Granulomatose mit Polyangiitis) – Dagegen spricht, dass es die Ehefrau auch hat.
Bin gespannt was rauskommt und hoffe, dass es dem Patienten besser geht.
Tobias Wagelöhner
OSA
Bundeswehrkrankenhaus Berlin
Juri Katchanov
Was für eine tolle Idee! Aber noch besser wäre sowas mit Telegramm oder Twitter zu machen - dann interaktiver. Ich glaube, dass der „Doxycycline-Deficient State“ eine Entität ist. Die Diagnosen wie Rickettsiosen (oder sogar Leptospirose) sind meistens Verlegenheitsdiagnosen, die auf fragwürdigen Serologien beruhen. Ihr habt ihn mit Doxy gerettet. Und DDS ist ja schon ein Terminus technicus:
https://ucsfmed.wordpress.com/2016/02/20/sfgh-report-pearls-doxycycline-deficient-states/
https://clinicalproblemsolving.com/dx-schema-doxycycline-deficiency-state/
Ganz liebe Grüße Juri
Priv.-Doz. Dr. med. Juri Katchanov
München
Sebastian Albus
Uns sind folgende Ideen gekommen: Von Susanne Weber per WhatsApp: Psittakosis: passend wäre die Exposition, das klinische Bild mit Pneumonie, Rash (Horder Spots) und Transaminasenerhöhung. Die Morphologie des Infiltrats, klinischer Erfolg von Doxy und negative BKs würden ebenfalls dafürsprechen. Zur Klärung könnten wir ein Rekonvaleszenzserum machen. Falls wir eine BAL / Biopsie machen, könnte Gewebe zur spezifischen PCR ins NRZ nach Jena geschickt werden. Von Sebastian Albus, der die Beatmungsstation bis morgen früh hüten muss und dem langweilig ist: Ich hatte zuerst an den Ausschluss profanerer DDs gedacht, die nur einen Teil der Symptome erklären: Hepatitis Serologien (inklusive HEV), 2* Legionellen AG im Urin (da Hotelaufenthalt + atypische Pneumonie + Doxy Response). Weiterhin hatte ich noch an Zoonosen gedacht, die durch Doxy besser werden: Q-Fieber (lt. Mandell gibt es auch ein Reservoir in Vögeln), Brucellose (passt vom klinischen Bild nicht so richtig (Lungenbeteiligung ist anscheinend sehr selten), es gibt lt. Mandell aber eine Spezies namens Brucella canis. Sie betrifft wohl Hunde und kann durch engen Kontakt mit denen übertragen werden). Dummerweise erfasst die normale Brucellen Serologie wegen antigenetischer Unterschiede nicht Infektionen mit B. canis. Kann ein Anruf beim Referenzzentrum helfen?
Wenn wir schon dabei sind, sollte der dicke Serologie Strich auch die Tularaemie mit einschließen: Mandell sagt es gibt sowohl eine pulmonale als auch eine typhoide Form ohne prominente Lymphadenopathie und anscheinend kann man das auch von Hunden kriegen, die Aas fressen: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5687813/.
Histoplasmose: sehr, sehr, sehr unwahrscheinlich, anscheinend gibt es aber autochtone Fälle in Spanien. Falls wir eine Broncho mit PE / CT gestützte Punktion machen, würde ich eine Grocott Färbung + Pilzkultur anfordern, und eine Serologie + Urin zu Prof. Rickerts ins RKI schicken (manchmal macht er die Untersuchungen sogar umsonst) Was sonst noch…?
Die Kombi Hepatitis + Rash lassen noch an eine Rickettsien Erkrankung denken (…waren das wirklich Ameisenstiche…?), aber mit den Lungenherden zusammen…passt nicht so richtig oder? Zuletzt und am unwahrscheinlichsten, Leptospirose (kein Rattenurin in Sicht, keine Nierenbeteiligung und Transaminasen > Bilirubin) aber wenn man gar nichts anderes findet, eine Serologie mehr oder weniger…
Jan Thiemeier tippt per WhatsApp auf Brucella canis.
So das war’s von uns, vielen Dank für das schöne Rätsel, wir freuen uns auf Eure Auflösung
Beste Grüße Sebastian
Dr. med. Sebastian Albus
Medizinische Klinik mit Schwerpunkt Infektiologie/Pneumologie
Charité
Victor Fadel
wir haben uns über Ihre interessante Fallschilderung Gedanken gemacht. Folgende Differentialdiagnosen erscheinen uns möglich:
- Rickettsiose
Begründung: makulopapulöses Exanthem mit Aussparung der Handflächen und Fußsohlen. Bei Übertragung durch Läuse und Flöhe ist laut Literatur kein Eschar zu erwarten, ebenso kann R. typhi sogar aerogen übertragen werden, in diesem Fall ist ebenfalls kein Eschar zu erwarten. Pneumonien sind durch bakterielle Superinfektionen möglich, Thrombopenie und Transaminaseerhöhung ist typisch; ebenso promptes Therapieansprechen auf Doxycyclin.
Die Serologie ist typischerweise erst nach 4 Wochen positiv, so dass wir vermuten, dass Sie einen negativen Befund aus Ihrem Labor erhalten haben.
- Rückfallfieber durch B. recurrentis / R. buttonii
Begründung: generell ähnliches Krankheitsbild, meistens jedoch mit Hepatosplenomegalie, was Ihr Patient nicht hatte. Weitere DDs die wir diskutiert aber eigentlich wieder verworfen haben sind Q-Fieber und Psittakose. Wir warten gespannt und hoffen sehr auf eine Auflösung.
Viele Grüße vom Mibi-Team der DRK Kliniken
Dr. med. Victor Fadel
Institut für Mikrobiologie
Marcos Rust
Also ich finde Rickettsia typhi einen guten Tipp.
Liebe Grüße Marcos
Dr. med. Marcos Rust Moreira
Zentrum für Infektionsmedizin
Vivantes, Netzwerk für Gesundheit GmbH
Thomas Weitzel
Mein Beitrag zum Brainstorming: klar, die Exposition, das klinische Bild und das Imaging lässt an atypische Erreger, eher zoonotisch, Kontakt Hund oder aviär denken. Ein Bild des Exanthems würde mich interessieren. Endemische Pilze (Histoplasmose in Südeuropa nicht unmöglich) sind bei Ansprechen auf Doxy unwahrscheinlich. Was kommt von diesen seltenen Sachen in Frage?: canine Ehrlichiose (E. canis) / Anaplasmose (A. platys) (beides wäre case report würdig), Rickettsia conorii (normalerweise Beteiligung Handflächen und Mucosa), aber auch andere Spezies sind möglich (z.B. R. massiliae, Überträger Rhipicephalus!), an Orientia denke ich auch immer (klar), bes. bei "Ameisenbissen", aber das wäre ein "first case", Brucella (canis!), Coxiella, Psittacose. Diagnostisch: Blutmaterial aus der Akutphase --> PCRs in Hamburg (und/oder Marseille), Serokonversion mit Serumpaar in ca. 3 Wochen (cave: es sollte eine Brucella canis Serologie sein, keine gute Kreuzreaktion mit anderen Spp.). Experte für Rickettsiosen in Spanien: José Antonio Oteo, Hospital San Pedro, Centro de Investigación Biomédica de La Rioja (CIBIR). Sicher per Email ansprechbar, sehr kompetent (!!) und nett (Grüsse von der Gruppe aus Chile, er hat uns mal besucht). So weit erstmal ins Grobe gesprochen und ohne große Recherche...
Liebe Grüße Thomas Weitzel
Dr. med. Thomas Weitzel DTM&P
Profesor Titular, Facultad de Medicina
Clínica Alemana, Universidad del Desarrollo
Santiago, Chile
Gerhard Boecken
Liebe Kollegen,
sind Moskitostiche erinnerlich? ich würde CHIK ausschließen wollen, hier gibt es auch selten Lungenbeteiligung, ob primär oder sekundär, kann man nur vermuten. Wenn es auf Doxy besser wurde, eher sekundär. Die Form des Exanthems passt aber eher nicht. Aber natürlich muss man auch die ganzen Rickettsiosen ausschließen, gerade weil es auf Doxy besser wurde.
Viele Grüße Gerhard Boecken
Dr. med. Gerhard Boecken
Auswärtiges Amt – Gesundheitsdienst
Provincia de Buenos Aires
Argentinien
Mirna Abd El Aziz
Sehr geehrtes Infektoskop-Team,
vielen Dank für die Veröffentlichung des spannenden Falles des Reiserückkehrers aus Teneriffa. Anbei sende ich Ihnen meine Gedanken zu möglichen Differenzialdiagnosen. Ich bin sehr gespannt auf die Fortsetzung des Falles im Infektoskop.
Differentialdiagnosen:
Ornithose (C. psittaci):
Dafür spricht:
- Exposition: Kontakt zu Taube / Vogelkot und -federstaub
- Symptomatik mit initial grippeähnlichen Symptomen und trockenem Husten
- Inkubationszeit von 1-4 Wochen würde passen
- Schwierig nachzuweisen (Speziallabor)
- Ansprechen auf Doxycyclin
Dagegen spricht:
- Keine Hepatosplenomegalie (Endo- / Myokarditis ?)
- Exanthem nicht typisch (?)
Muriner Typhus:
Dafür spricht:
- Exposition
- Passende Klinik: unspezifische Symptomatik mit Fieber, Kopfschmerzen, makulöses Exanthem, das Hand- und Fußsohlen ausspart (typische Trias: Fieber, Kopfschmerzen, Exanthem)
- Thrombozytopenie
- Ansprechen auf Doxycyclin
Dagegen spricht:
- Röntgenbild/CT Thorax nicht ganz passend
Mittelmeerfleckfieber (R. conorii):
Dafür spricht:
- Exposition: Kontakt zu einem Hund
- Passende Symptomatik mit Fieber, Myalgien, Exanthem
- Ansprechen auf Doxycyclin
Dagegen spricht:
- Fehlen eines Eschars
Leptospirose:
Dafür spricht:
- Passende Inkubationszeit (5-14 Tage nach Exposition à passt auf die Freundin und den Patienten selbst)
- Passende Symptomatik: Fieber, Gelenk- und Muskelschmerzen, Exanthem, Kopf- und Nackenschmerzen, trockener
Husten
- Labor: Thrombozytopenie
- Ansprechen auf Doxycyclin (Th. der Wahl bei leichten Verläufen)
- Mögliche Exposition: der Hund in Teneriffa, mögl. Zusätzlich Exkremente von Ratten/Mäusen zwischen dem Vogelkot im Frühstückssaal?
Dagegen spricht:
- Laborchemisch hätte man ggf. erhöhte Nierenretentionsparameter erwartet
- Fehlende Hepatosplenomegalie
- Kein Ikterus
- Pulmonale Beteiligung bei Leptospirose a.e. ausgeprägter (?) à vgl.: Leptospirosis of the Lung: High-Resolution Computed Tomograp... : Journal of Thoracic Imaging (lww.com)
Dengue:
Dafür spricht:
- Symptomatik: Fieber, Myalgien, Arthralgien, retrobulbäre Schmerzen, makulöses Exanthem
- Thrombozytopenie
Dagegen spricht:
- Eher moderate Transaminasenerhöhung erwartet
- Zeitlicher Verlauf nicht ganz passend
- Ansprechen auf Doxycyclin eher untypisch
Legionellose:
Dafür spricht:
- Exposition: mögliche Übertragung durch Duschen / Whirlpools in der Ferienanlage (Anamnese?)
- Labor: LDH-, CRP-Erhöhung, Thrombozytopenie
- Passende Symptomatik: Fieber, trockener Husten, Myalgien, Kopfschmerzen
- Pulmonale Beteiligung mit Milchglasinfiltraten möglich
Dagegen spricht:
- Schwerer Verlauf bei immunkompetentem Patienten
- Doxycyclin nicht das Antibiotikum der Wahl
- Radiologisch ggf. ausgeprägterer Befund erwartet
Offene Fragen:
Falls die Freundin sich spontan erholt hat: ggf. hatte sie ein Pontiac Fieber, der Patient jedoch Legionnaires‘ disease
Gab es noch mehr Fälle unter den Urlaubern in Teneriffa?
Hatte der Patient eine Hyponatriämie? (oft bei Legionellose, er hätte damit dann alle prädiktiven laborchemischen und klinischen Faktoren für eine Legionellose erfüllt, die in diesem BMC-Artikel von 2008 vorgeschlagen werden: 1471-2466-9-4.fm (nih.gov))
Wurde eine BAL durchgeführt und gezielt eine Legionellen-Kultur angefordert?
Wie war der Verlauf der Erkrankung bei der Freundin? Gingen das Fieber und der Hautausschlag spontan weg? Hat sie ebenfalls eine pulmonale Manifestation / auffällige Bildgebung?
Handelte es sich wirklich um „Ameisenstiche“ oder andere Stiche / Bisse? Hat der Patient auf Tenerifa einzelne Stiche bemerkt, oder nur das generelle Exanthem?
Mit freundlichen Grüßen,
Dr. med. Mirna Abd El Aziz
Universitätsklinikum Heidelberg
Literatur
- Robaina-Bordón JM, Carranza-Rodríguez C, Hernández-Cabrera M, Bolaños-Rivero M, Pisos-Álamo E, Jaén-Sánchez N, Hernández-Betancor A, Suárez-Hormiga L, Pérez-Arellano JL: Murine Typhus in Canary Islands, Spain, 1999-2015. Emerging infectious diseases 2021, 27(2):570-573, DOI: 10.3201/eid2702.191695.
- Nogueras MM, Pons I, Pla J, Ortuño A, Miret J, Sanfeliu I, Segura F: The role of dogs in the eco-epidemiology of Rickettsia typhi, etiological agent of Murine typhus. Veterinary microbiology 2013, 163(1-2):97-102, DOI: 10.1016/j.vetmic.2012.11.043.
- Chaliotis G, Kritsotakis EI, Psaroulaki A, Tselentis Y, Gikas A: Murine typhus in central Greece: epidemiological, clinical, laboratory, and therapeutic-response features of 90 cases. International journal of infectious diseases : IJID : official publication of the International Society for Infectious Diseases 2012, 16(8):e591-596, DOI: 10.1016/j.ijid.2012.03.010.
- Faccini-Martínez Á A, García-Álvarez L, Hidalgo M, Oteo JA: Syndromic classification of rickettsioses: an approach for clinical practice. International journal of infectious diseases : IJID : official publication of the International Society for Infectious Diseases 2014, 28:126-139, DOI: 10.1016/j.ijid.2014.05.025.
- Zhang A, Xia X, Yuan X, Lv Y, Liu Y, Niu H, Zhang D, Liang J: Clinical characteristics of 14 cases of severe Chlamydia psittaci pneumonia diagnosed by metagenomic next-generation sequencing: A case series. Medicine 2022, 101(24):e29238, DOI: 10.1097/md.0000000000029238.
- Velasco-Tirado V, Hernández-Cabrera M, Pisos-Álamo E, Pérez-Arellano JL: Rickettsia typhi. A new causative agent of round pneumonia in adults. Enfermedades infecciosas y microbiologia clinica 2012, 30(7):427-428, DOI: 10.1016/j.eimc.2012.02.008.
- Montoya-Alonso JA, Morchón R, Costa-Rodríguez N, Matos JI, Falcón-Cordón Y, Carretón E: Current Distribution of Selected Vector-Borne Diseases in Dogs in Spain. Frontiers in veterinary science 2020, 7:564429, DOI: 10.3389/fvets.2020.564429.
- Li H, Zhou Y, Wang W, Guo D, Huang S, Jie S: The clinical characteristics and outcomes of patients with human granulocytic anaplasmosis in China. International journal of infectious diseases : IJID : official publication of the International Society for Infectious Diseases 2011, 15(12):e859-866, DOI: 10.1016/j.ijid.2011.09.008.
- Dumler JS, Madigan JE, Pusterla N, Bakken JS: Ehrlichioses in humans: epidemiology, clinical presentation, diagnosis, and treatment. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2007, 45 Suppl 1:S45-51, DOI: 10.1086/518146.
- Branley JM, Weston KM, England J, Dwyer DE, Sorrell TC: Clinical features of endemic community-acquired psittacosis. New microbes and new infections 2014, 2(1):7-12, DOI: 10.1002/2052-2975.29.
- Millán Mon A, Argany Fajardo A, Febles Bethencourt J, González Caloca C, Vento Remedios TE, Fernández Cabrera M: [Q fever on the island of La Palma. A review of 35 patients]. Anales de medicina interna (Madrid, Spain : 1984) 1989, 6(10):527-530, DOI:
- Raoult D, Tissot-Dupont H, Foucault C, Gouvernet J, Fournier PE, Bernit E, Stein A, Nesri M, Harle JR, Weiller PJ: Q fever 1985-1998. Clinical and epidemiologic features of 1,383 infections. Medicine 2000, 79(2):109-123, DOI: 10.1097/00005792-200003000-00005.
- Heo JY, Choi YW, Kim EJ, Lee SH, Lim SK, Hwang SD, Lee JY, Jeong HW: Clinical characteristics of acute Q fever patients in South Korea and time from symptom onset to serologic diagnosis. BMC infectious diseases 2019, 19(1):903, DOI: 10.1186/s12879-019-4479-0.
- Wielders CC, Wuister AM, de Visser VL, de Jager-Leclercq MG, Groot CA, Dijkstra F, van Gageldonk-Lafeber AB, van Leuken JP, Wever PC, van der Hoek W et al: Characteristics of hospitalized acute Q fever patients during a large epidemic, The Netherlands. PloS one 2014, 9(3):e91764, DOI: 10.1371/journal.pone.0091764.











